Co je oxid uhelnatý? Struktura molekuly
Oxid uhelnatý, známý také jako oxid uhelnatýplyn, má velmi silné molekulové složení, je inertní ve svých chemických vlastnostech a špatně rozpustný ve vodě. Tato sloučenina je také neuvěřitelně toxická, když vstoupí do dýchacího systému, kombinuje se s hemoglobinem v krvi a přestává přenášet kyslík do tkání a orgánů.

Chemické názvy a vzorce
Oxid uhelnatý je také znám pod jinýminázvy, včetně oxidu uhelnatého II. V každodenním životě se obvykle nazývá oxid uhelnatý. Tento oxid uhelnatý je toxický, bezbarvý a bez chuti plyn, který je bez zápachu. Jeho chemický vzorec je CO a hmotnost jedné molekuly je 28,01 g / mol.

Účinky na tělo
Oxid uhelnatý se kombinuje s hemoglobinemtvorba karboxyhemoglobinu, který nemá kapacitu kyslíku. Vdechnutí výparů způsobuje poškození centrálního nervového systému (CNS) a udušení. Výsledný nedostatek kyslíku způsobuje bolest hlavy, závratě, pokles pulzu a respirační frekvence, což vede k mdloby a následné smrti těla.

Toxický plyn
Oxid uhelnatý se vyrábí částečněspalování látek obsahujících uhlík, například v motorech s vnitřním spalováním. Sloučenina obsahuje 1 atom uhlíku, kovalentně vázaný na 1 atom kyslíku. Oxid uhelnatý je velmi toxický a jedná se o jednu z nejčastějších příčin smrtelných otrav ve světě. Expozice může vést k poškození srdce a dalších orgánů.

Co je použití oxidu uhelnatého?
I přes jeho závažnou toxicitu, monoxiduhlík je mimořádně užitečný - díky moderní technologii je z něj vytvořeno množství životně důležitých produktů. Oxid uhelnatý, i když se dnes považuje za znečišťující látku, byl vždy přítomen v přírodě, ale ne v takových množstvích, jako je například oxid uhličitý.
Ti, kteří věří, že neexistují, jsou mylníoxidu uhelnatého v přírodě. CO se rozpouští v roztavené vulkanické hornině při vysokých tlacích v plášti země. Obsah oxidů uhlíku v vulkanických plynech se pohybuje v rozmezí od 0,01% do 2%, v závislosti na sopce. Vzhledem k tomu, že přirozená hodnota této sloučeniny není konstantní hodnotou, není možné přesně měřit emise zemního plynu.

Chemické vlastnosti
Oxid uhelnatý (vzorec CO) se vztahuje na oxidy, které nejsou soli nebo indiferenty. Nicméně při teplotě +200 oC reaguje s hydroxidem sodným. Během tohoto chemického procesu se vytvoří mravenčan sodný:
NaOH + CO = HCOONa (sůl kyseliny mravenčí).
Vlastnosti oxidu uhelnatého jsou založeny na jeho redukční schopnosti. Oxid uhelnatý:
- může reagovat s kyslíkem: 2CO + O2 = 2CO2;
- schopná reagovat s halogeny: CO + Cl2 = COCI2 (fosgen);
- má jedinečnou vlastnost k získání čistých kovů z jejich oxidů: Fe2O3 + 3CO = 2Fe + 3CO2;
- tvoří karbonyly kovů: Fe + 5CO = Fe (CO)5;
- dokonale rozpustný v chloroformu, kyselině octové, ethanolu, hydroxidu amonném a benzenu.

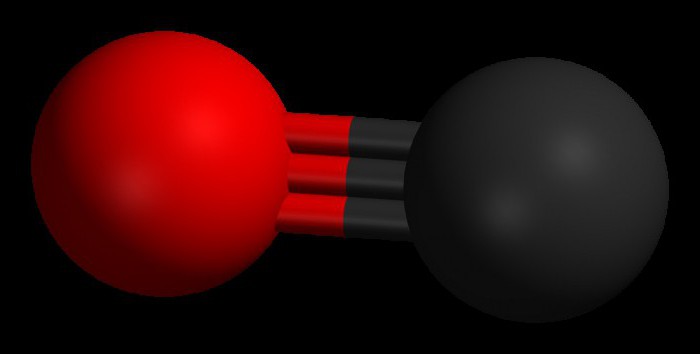
Molekulární struktura
Dva atomy, ze kterých vlastně sestávámolekula oxidu uhelnatého (CO) jsou spojeny trojitou vazbou. Dvě z nich jsou tvořeny fúzí p-elektronů atomů uhlíku s kyslíkem a třetí je způsobeno zvláštním mechanismem kvůli volným 2p-orbitalům uhlíku a 2p-elektronovým kyslíkovým párům. Tato struktura poskytuje molekulu s vysokou pevností.

Trochu historie
Aristoteles ze starověkého Řecka popsaljedovaté plyny vznikající při hoření uhlí. Mechanismus samotné smrti nebyl znám. Jedním ze starodávných způsobů popravy však bylo zablokování přestupkového zákona v parní místnosti, kde se nacházela uhlí. Řecký lékař Galen naznačil, že ve vzduchu vznikají určité změny, které při vdechování způsobují škody.
Během druhé světové války, směs plynu snečistoty oxidu uhelnatého, byla použita jako palivo pro vozidla v těch částech světa, kde došlo k omezené množství benzínu a motorové nafty. externí (až na výjimky) generátory uhlí nebo dřevoplyn byly stanoveny, ale směs atmosférického dusíku, oxidu uhelnatého, a malá množství dalších plynů přiváděných do plynové mixéru. Byl to tzv. Dřevěný plyn.
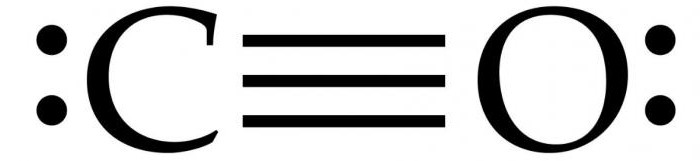
Oxidace oxidu uhelnatého
Oxid uhelnatý je tvořen částečnou oxidací sloučenin obsahujících uhlík. CO vzniká, když kyslík není dostatečný k produkci oxidu uhličitého (CO2), například když pec nebo motor běžíspalování v uzavřeném prostoru. Pokud je přítomen kyslík, stejně jako některé jiné atmosférické koncentrace, hoří oxid uhelnatý, který vydává modré světlo a vytváří oxid uhličitý, známý jako oxid uhličitý.
Uhlíkový plyn, široce používaný až do šedesátých letV minulém století pro vnitřní osvětlení, vaření a ohřev měl CO v kompozici jako výhodnou složku paliva. Některé procesy v moderních technologiích, jako je tavení železa, stále produkují oxid uhelnatý jako vedlejší produkt. Samotná sloučenina CO je oxidována v CO2 při pokojové teplotě.

Existuje CO příroda?
Existuje v přírodě oxid uhelnatý? Jedním z jeho přirozeně se vyskytujících zdrojů jsou fotochemické reakce vyskytující se v troposféře. Tyto procesy by měly generovat asi 5 × 1012 kg látky e; Jiné zdroje, jak již bylo uvedeno výše, jsou sopky, lesní požáry a další druhy hoření.
Molekulární vlastnosti
Oxid uhelnatý má molární hmotnost 28,0, což jeje o něco méně hustá než vzduch. Délka vazby mezi těmito dvěma atomy je 112,8 mikrometrů. Je dost blízko, že poskytuje jednu z nejsilnějších chemických vazeb. Oba prvky ve sloučenině CO mají dohromady asi 10 elektronů v jednom valenčním plášti.
Obvykle je v organickém karbonusloučenin je dvojná vazba. Charakteristickým znakem molekuly CO je to, že mezi atomy existuje silná trojná vazba se 6 obecnými elektrony ve 3 navzájem propojených molekulárních orbitech. Protože 4 společné elektrony pocházejí z atomu kyslíku a pouze 2 z uhlíku, jedna vázaná orbita je obsazena dvěma elektrony z O2, tvořící dativní nebo dipolovou vazbu. To způsobuje polarizaci C ← O molekuly s malým nábojem "-" na uhlíku a malým nábojem "+" na kyslíku.
Zbývající dvě přidružené orbitaly zaujímají jednunabitých částic na uhlíku a jeden na kyslík. Molekula je asymetrická: kyslík má větší hustotu elektronů než uhlík, a je také mírně pozitivně nabitá, v porovnání s negativní uhlíku.
Příjem
V průmyslu se výroba oxidu uhelnatého CO provádí zahříváním bez přístupu vzduchu nebo oxidu uhličitého vzduchem s uhlí:
CO2 + C = 2CO;
H2O + C = CO + H2.
Poslední získaná směs se nazývá také vodanebo syntézního plynu. V laboratorních podmínkách oxid uhelnatý II vystavením organických kyselin koncentrované kyselině sírové, která působí jako dehydratační činidlo:
HCOOH = CO + H2O nás
H2C2O4 = CO2 + H2O.
Hlavní příznaky a pomoc při otravě CO
Je otravou oxidem uhelnatým? Ano, a velmi silná. Otravy oxidem uhelnatým jsou nejčastějším jevem na celém světě. Mezi nejčastější příznaky patří:
- pocit slabosti;
- nevolnost;
- závratě;
- únavu;
- podrážděnost;
- špatná chuť k jídlu;
- bolesti hlavy;
- dezorientace;
- zhoršené vidění;
- zvracení;
- mdloby;
- křeče.
Expozice tohoto toxického plynu může způsobitk významným škodám, které mohou často vést k dlouhodobým chronickým patologickým stavům. Oxid uhelnatý může způsobit vážné poškození plodu těhotné ženy. Oběti, například po požáru, by měly mít okamžitou pomoc. naléhavě je třeba zavolat sanitku, dát přístup k čerstvému vzduchu, odstranit nepříjemné dýchání, klidné, teplé. Těžká otrava je zpravidla léčena pouze pod dohledem lékařů v nemocnici.
Aplikace
Oxid uhelnatý, jak již bylo zmíněno, je toxický aJe to nebezpečné, nicméně jde o jednu ze základních sloučenin používaných v moderním průmyslu pro organickou syntézu. CO se používá k výrobě čistých kovů, karbonylů, fosgenu, sulfoxidu uhlíku, methylalkoholu, formamidu, aromatických aldehydů, kyseliny mravenčí. Tato látka se také používá jako palivo. Přes svou toxicitu a toxicitu se často používá jako surovina pro získání různých látek v chemickém průmyslu.
Oxid uhelnatý a oxid uhličitý: jaký je rozdíl?
Monoxid a oxid uhličitý (CO a CO2) se často navzájem mýlí. Oba plyny jsou bez zápachu, bezbarvý, a oba mají negativní vliv na kardiovaskulární systém. Oba plyny mohou vstoupit do těla prostřednictvím inhalace, pokožky a očí. Tyto sloučeniny při osvitu pro živé organismy mají řadu příznaků - bolesti hlavy, závratě, křeče a halucinace. Většina lidí jen těžko dělat rozdíl a neuvědomují si, že výfukové auto emitovány jako CO a CO2 . Uvnitř může být zvýšení koncentrace těchto plynů nebezpečné pro zdraví a bezpečnost osoby, která je vystavena. Jaký je rozdíl?
Při vysokých koncentracích mohou být oba fatální. Rozdíl je v tom, že CO2 je společný zemní plyn nezbytný proveškerý rostlinný a živočišný život. CO není běžný výskyt. Jedná se o vedlejší produkt spalování anoxických paliv. Kritickým chemickým rozdílem je CO2 obsahuje jeden atom uhlíku a dva atomy kyslíku, zatímco v CO je pouze jeden z nich. Oxid uhličitý je nehořlavý, zatímco oxid siřičitý má vysokou pravděpodobnost vznícení.
Oxid uhličitý se přirozeně vyskytuje vatmosféra, lidé a zvířata dýchají kyslík a vydechujeme oxid uhličitý, to znamená, že živé bytosti jsou schopny odolat tomu v malém množství. Tento plyn je také nezbytný pro to, aby rostliny prováděly fotosyntézu. Oxid uhelnatý však v atmosféře přirozeně nevzniká a může způsobit zdravotní problémy i v nízkých koncentracích. Hustota obou plynů je také odlišná. Oxid uhličitý je těžší a hustší než vzduch, zatímco oxid uhelnatý je mírně lehčí. Tato funkce by měla být brána v úvahu při instalaci vhodných čidel v domácnostech.






