Biologická role aminokyselin a jejich aplikace
Jaká je biologická role aminokyselin? Pokusíme se společně najít odpověď na tuto otázku. Zjistili jsme zvláštnosti struktury této třídy organických látek, jejich chemické vlastnosti, hlavní oblasti použití.

Historické pozadí
První otevřenou aminokyselinou byla glycin. Byl syntetizován v roce 1820 kyselou hydrolýzou želatiny. Dešifrovat složení aminokyselin proteinových molekul bylo možné až do poloviny minulého století, pak se objevila aminokyselina - threonin.
Hlavní funkce
V současné době existuje informace o 300 aminokyselinách, které v těle plní různé funkce.
Jaká je hlavní biologická role aminokyselin? Dvacet z nich je považováno za standardní (proteinogenní), protože jsou součástí hlavních proteinových molekul.
Tyto sloučeniny jsou součástí jistých proteinů. Oxiprilin je základem kolagenu, elastin tvoří desmosin.
Mohou být meziprodukty v metabolických procesech. Tato funkce se provádí citrulinem, ornitinem.
Biologická funkce aminokyselin spočívá také v syntéze nukleotidů, polyamidů. Uhlíkový řetězec těchto sloučenin se používá k vytvoření dalších organických látek:
- glukóza je syntetizována z glukogenních aminokyselin;
- lipidy jsou tvořeny ketogenními sloučeninami.
Biologická role aminokyselin jemožnost jejich použití pro definování funkčních skupin. Cystein se používá při detekci sulfátové skupiny. Aspartát se používá při detekci aminoskupiny.

Funkce nomenklatury
Jak správně pojmenovat aminokyseliny? Struktura, klasifikace, biologická role těchto sloučenin se zvažuje i v průběhu školního vzdělávacího programu.
Aminokyseliny jsou deriváty karboxylových kyselin, ve kterých je jeden atom vodíku nahrazen aminoskupinou.
V závislosti na umístění této funkceskupin, jedna sloučenina může mít několik isomerů. Lékárníci najednou používají tři různá nomenklatury: racionální, triviální, systematické.
Názorné názvy těchto sloučenin se vztahujízdroj, ze kterého byly přiděleny. Serin je součástí vláknitého hedvábí, glutamin se nachází v lepku obilovin. Cystin je přítomen v kamenech močového měchýře.
Racionální název se vztahuje k derivátukarboxylová kyselina a zkratka označuje sekvenci aminokyselin v proteinové molekule. V biochemii se používají zkrácené a triviální názvy těchto sloučenin.

Klasifikace aminokyselin
Abychom pochopili biologickou úlohu aminokyselin a jejich použití, podrobněji se zabýváme typy klasifikace těchto organických sloučenin.
V současné době se používá několik typů klasifikace:
- radikál;
- podle stupně jeho polarity;
- na variantě syntézy v těle.
Podle zbytek struktury různých druhů aminokyselin, izolované v organické chemii.
Alifatické sloučeniny mohou obsahovat jednu karboxylovou skupinu a aminovou skupinu, v tomto případě jsou to monoaminokarbonové sloučeniny.
V přítomnosti dvou COOH a jedné aminoskupiny se látky označují jako monoamino-dikarboxylové látky.
Rovněž jsou izolovány diaminomonokarboxylové a diaminodikarboxylové formy aminokyselin.
Cyklické druhy se liší nejen počtem cyklů, ale také jejich kvalitativním složením.
Podle Lenina jsou aminokyseliny rozděleny do čtyř skupin podle rysů interakce uhlovodíkového radikálu s vodou:
- hydrofobní;
- hydrofilní;
- negativně nabitý;
- kladně nabitý.
V závislosti na schopnost syntetizovat aminokyselinu v lidském těle vylučují základní (ACT s jídlem), a výměnnými typy.
Četné vědecké experimenty prokázaly biologickou úlohu alfa-aminokyselin.

Fyzikální vlastnosti
Jaké jsou vlastnosti aminokyselin? Nomenklatura, vlastnosti, biologická úloha těchto sloučenin se nabízí absolventům škol na jednotné státní zkoušce chemie. Tyto organické kyseliny jsou vysoce rozpustné ve vodě, mají vysokou teplotu tání.
Jejich optická aktivita je vysvětlena přítomností asymetrického atomu uhlíku v molekulách (s výjimkou samotného glycinu). Proto byly objeveny L- a D-stereoisomery aminokyselin.
Izomery řady L se nacházejí ve zvířecích bílkovinách. Hodnota indexu vodíku pro tyto sloučeniny je v rozmezí 5,5-7.

Chemické vlastnosti
Zvažme aminokyseliny podrobněji. Musí být známa struktura, chemické vlastnosti, biologická úloha těchto organických látek.
Specificita chemických vlastností aminokyselin spočívá v jejich dualitě. Příčinou amfotericity je přítomnost dvou funkčních skupin v těchto organických kyselinách.
Přítomnost karboxylové skupiny COOH se provádítyto sloučeniny jsou kyselé. Snadno reagují s aktivními kovy, základními oxidy, zásadami. Také vlastnosti kyselosti těchto organických sloučenin je uveden v esterifikační reakci (s alkoholy za vzniku esterů).
Aminokyseliny mohou také vstoupit do chemikálieinterakce se solemi tvořenými slabými minerálními kyselinami. Jako příklad takové reakce lze uvažovat o interakci aminokyselin s bikarbonáty a uhličitany.
Hlavními vlastnostmi této třídy je schopnost aminokyselin reagovat s jinými kyselinami na aminoskupině. V tomto případě se tvoří soli.
Biologická úloha dekarboxylace aminokyselin spočívá v tom, že se vytvoří neutrální médium, které je pro živý organismus naprosto bezpečné.
Ninhydrinová reakce umožňuje detekovat vroztok aminokyselin. Podstata reakce spočívá v tom, že bezbarvý roztok ninhydrinu, který interaguje s aminokyselinou, bude kondenzovat ve formě dimeru přes atom dusíku, který se odštěpí od aminoskupiny odpovídající kyseliny.
Výsledný pigment vykazuje červený philyelitový odstín, navíc dekarboxylace aminokyseliny vede k tvorbě určitého aldehydu a oxidu uhelnatého (4).
Jedná se o ninhydrinovou reakci, která se používábiologů v analýze primární struktury proteinových molekul. Podle intenzity barvy je možné zjistit kvantitativní obsah aminokyselin v počátečním roztoku, proto je tato analýza vhodná pro stanovení koncentrace aminokyselin.
Specifické reakce
V aminokyselinách mohou být kromě karboxylových a aminoskupin přítomny další funkční skupiny. Pro jejich stanovení ve výzkumných laboratořích provádějí kvalitativní reakce.
Arginin může být detekován ve směsi prováděním kvalitativní Sakaguchi reakce (na guanidinové skupině). Cystein může být určen metodou Fole, která je specifická pro skupinu SH.
Nitrační reakce (xantoproteinová reakce)umožňuje potvrdit přítomnost aromatické aminokyseliny ve směsi. Millonova reakce je určena k identifikaci hydroxylové skupiny v aromatickém kruhu tyrosinu.
Vlastnosti vazby peptidů
Jaké jsou vlastnosti aminokyselin obsahujících síru? Jejich biologická úloha je spojena s tvorbou peptidových molekul. Když vzájemně interagují několik molekul aminokyselin, molekuly vody se štěpí a aminokyselinové zbytky tvoří peptidy s použitím peptidové (amidové) vazby.
Počet vzniklých aminokyselinových zbytkůpolypeptidu, se významně liší. Ty peptidy, které obsahují ne více než deset aminokyselinových zbytků, označované jako oligopeptidy. Název výsledné sloučeniny je často indikován počtem aminokyselinových zbytků.
Pokud látka obsahuje více než desetaminokyselinové zbytky se tyto sloučeniny nazývají polypeptidy. U těch sloučenin, které obsahují více než padesát aminokyselinových zbytků, se jejich syntéza nazývá protein.
Takže hormon glukagon, který obsahuje 29aminokyseliny, biologové volají hormon. Aminokyselinové zbytky jsou považovány za monomery počátečních organických kyselin, ze kterých se tvoří proteinové sloučeniny.
Tento aminokyselinový zbytek, který je napsán nalevo, má aminoskupinu, nazývá se N-terminál, fragment s karboxylovou skupinou je považován za C-terminál, je obvyklé psát to vpravo.
Při pojmenování výsledného polypeptidupoužijte zkrácené názvy aminokyselin, z nichž se tvoří. Například pokud se do interakce podílejí glycin, serin, alanin, výsledný tripeptid se bude číst jako glycilserilalanin.
Význam některých aminokyselin
Glycin (aminooctová kyselina) je dárcem uhlíku fragmentů, které jsou nezbytné pro tvorbu hemoglobinu, pyrrol, cholin, nukleotidy, jakož i pro syntézu kreatinu.
Serin je přítomen v aktivních enzymových centrech. Tato aminokyselina je potřebná pro syntézu fosfoproteinu (kaseinu přírodního mléka).
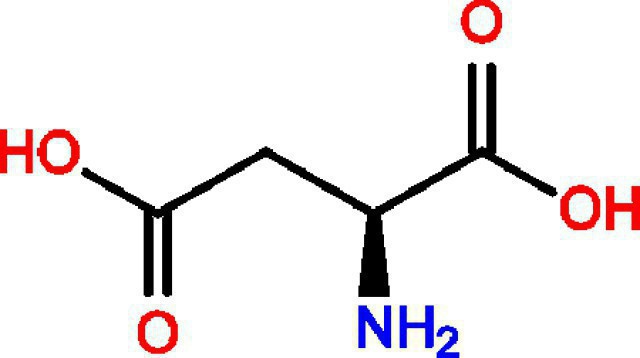
K tvorbě kyseliny glykogenové je zapotřebísekundární, terciární struktura proteinové molekuly. Tato sloučenina je nejvíce reaktivní funkční skupina, tak, že se látka snadno podléhá procesy oxidačně-redukční, váže těžké kovy jako nerozpustné sloučeniny. To ona slouží jako donor skupiny síran, požadavek pro syntézu látek obsahujících síru.
Závěr
Aminokyseliny jsou amfoterní organickésloučeniny mající významný biologický význam. To jsou aminokyselinové zbytky v syntéze, které tvoří sekvenci, která je primární strukturou molekuly proteinu. V závislosti na tom, jak přesně jsou fragmenty aminokyselin vybudovány, je syntetizován protein specifický pro každý živý organismus.






