Nejtěžší plyn. Radioaktivní plyn radon: vlastnosti, vlastnosti, poločas
Plyn je jedním ze souhrnných stavů hmoty. Plyny jsou přítomny nejen ve vzduchu na Zemi, ale i ve vesmíru. Jsou spojeny s lehkostí, beztíží, volatilitou. Nejjednodušší je vodík. A který plyn je nejtěžší? Zjistíme to.
Nejtěžší plyny
Slovo "plyn" pochází z řeckého slova"Chaos". Jeho částice jsou mobilní a slabě propojené. Chaoticky se pohybují a naplňují si veškerý prostor, který mají k dispozici. Plyn může být jednoduchým prvkem a skládá se z atomů jedné látky a může být složen z několika.

Nejjednodušší těžký plyn (v podmínkách místnostiteplota) je radon, jeho molární hmotnost je 222 g / mol. Je radioaktivní a absolutně bezbarvý. Po tom nejtěžší je xenon, jehož atomová hmotnost je 131 g / mol. Zbývající těžké plyny jsou sloučeniny.
Mezi anorganickými sloučeninami je nejtěžší plyn při teplotě +20 ° C oC je fluorid wolframu (VI). Jeho molární hmotnost je 297,84 g / mol a jeho hustota je 12,9 g / l. Za normálních podmínek je to bezbarvý plyn, ve vlhkém vzduchu kouří a zčervenává. Oxid volfrámového hexafluoridu je velmi aktivní, snadno se přemění na kapalinu po ochlazení.
Radon
Objev plynu došlo běhemstudium radioaktivity. V průběhu rozpadu některých prvků vědci opakovaně zaznamenali látku vypouštěnou spolu s dalšími částicemi. E. Rutherford nazval to emanací.
Tak, emanace thorium - thoron, radium- radon, aktinium - aktinon. Později bylo zjištěno, že všechny tyto emanace jsou izotopy stejného prvku - inertního plynu. Robert Gray a William Ramsay ho nejprve izolovali ve své čisté podobě a změřili jeho vlastnosti.
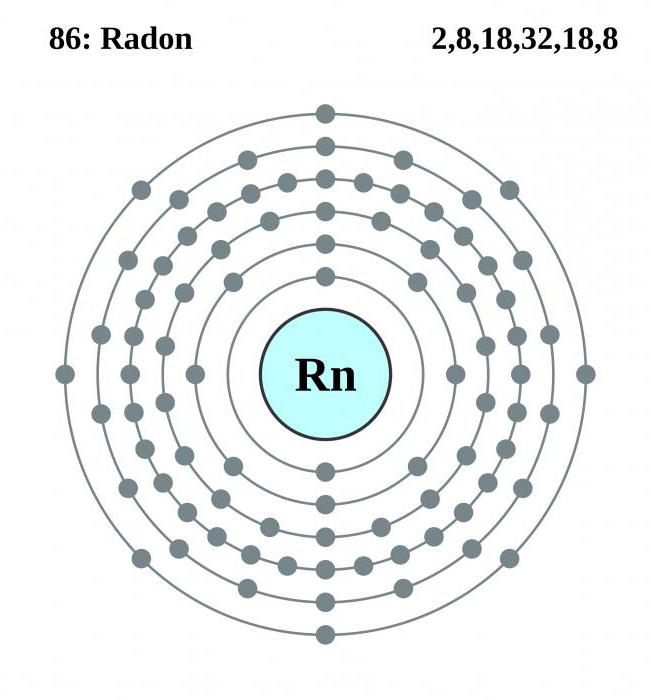
V periodické tabulce Mendelejeva je radonelement 18. skupiny s atomovým číslem 86. Umístěný mezi astatinem a Francií. Za normálních podmínek je látka plynná, nemá chuť, vůni a barvu.
Plyn je 7,5krát hustší než vzduch. Rozpustí se ve vodě lépe než jiné vzácné plyny. V rozpouštědlech je tato hodnota ještě větší. Ze všech vzácných plynů On je nejaktivnější, snadno interagovat s fluorem a kyslíkem.
Radonový radioaktivní plyn
Jednou z vlastností prvku je radioaktivita. Prvek má asi třicet izotopů: čtyři přirozené, zbytek - umělé. Všechny jsou nestabilní a jsou vystaveny radioaktivnímu rozkladu. Poločas rozpadu radonu, konkrétně nejstabilnějšího izotopu, je 3,8 dne.
Vzhledem k vysoké radioaktivitě má plyn plynfluorescence. V plynném a kapalném stavu je látka označena modře. Pevný radon mění svou paletu ze žluté na červenou, když je ochlazena na teplotu dusíku - asi -160 oC.
Radon může být pro člověka velmi toxický. V důsledku rozpadu se tvoří těžké netěkavé produkty, například polonium, olovo, vizmut. Jsou extrémně špatně vylučovány z těla. Usazováním a hromaděním tyto látky otráví tělo. Po kouření je radon druhou nejčastější příčinou rakoviny plic.
Umístění a aplikace radonu
Nejtěžší plyn je jeden z nejvzácnějšíchprvky zemské kůry. V přírodě, radon je součástí rud obsahujících uran-238, thorium-232, uran-235. Na svém úpadku je propuštěn, spadající do atmosféry a hydrosféry země.
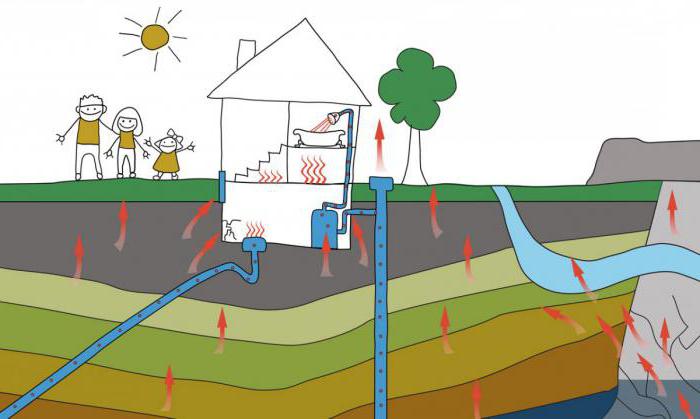
Radon se hromadí v říčních a mořských vodách v Čecháchrostlin a půdy, ve stavebních materiálech. V atmosféře se jeho obsah zvyšuje s aktivitou sopky a zemětřesení, při extrakci fosfátů a práci geotermálních elektráren.
S pomocí tohoto plynu tektonickýzávady, ložiska thoria a uranu. Používá se v zemědělství k aktivaci krmiv pro domácí zvířata. Radon se používá v metalurgii, při studiích podzemních vod v hydrologii jsou radonové lázně oblíbené v medicíně.